El equipo del Centro Nacional de Investigaciones Oncológicas descubre una conexión entre los nutrientes y el linfoma folicular y propone una posible vía terapéutica para el tratamiento de estos tumores.
El cáncer despliega una gran cantidad de recursos para poder crecer: desde la inestabilidad en su genoma a la inflamación, pasando por la creación de nuevos vasos sanguíneos, el aprovechamiento del microambiente que rodea al tumor o el uso de mecanismos que le permiten ser inmortal, entre otros. En el Centro Nacional de Investigaciones Oncológicas (CNIO), el Grupo de Metabolismo y Señalización Celular que dirige Alejo Efeyan estudia cómo el cáncer emplea uno de estos recursos, los nutrientes, en su propio beneficio, centrándose en una importante ruta metabólica que coordina el gen mTOR. Ahora, su equipo identifica el papel de esta ruta como origen de los linfomas foliculares y propone la exploración en futuros estudios de una posible estrategia terapéutica con un fármaco que ya está en clínica para otros tumores.
El linfoma folicular es un tipo de cáncer que aparece en los glóbulos blancos del sistema linfático, y es consecuencia del crecimiento descontrolado de estas células del sistema inmune. Se da en unos 5-7 casos por 100.000 habitantes, es el segundo tipo de linfoma más frecuente y su incidencia va en aumento.
Los investigadores han observado que uno de cada seis pacientes de linfoma folicular presenta mutaciones en RagC, un gen de la ruta de señalización de mTOR. A mTOR puede definírsele como un director de orquesta de las células, porque integra y coordina numerosas señales moleculares que le llegan a través de distintos informantes para autorizar el crecimiento celular. Precisamente uno de los informantes de la vía de señalización de mTOR es RagC, que actúa como un interruptor on/off que contribuye a que mTOR desencadene el crecimiento celular solamente en presencia de los nutrientes y la energía necesarios para abastecer el crecimiento del batallón de las células B.
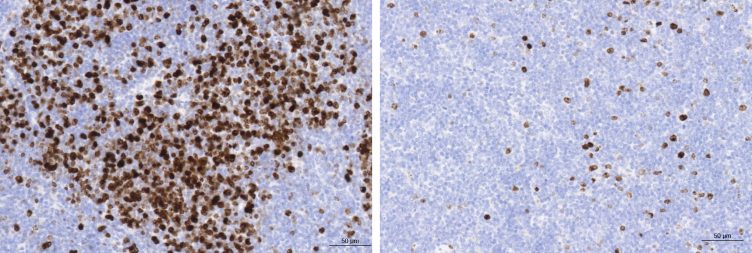
Para saber si las mutaciones en RagC estaban detrás del origen de los linfomas foliculares y no eran tan solo una consecuencia del caos genético propio de tumores con múltiples mutaciones, los investigadores del CNIO trabajaron con dos modelos de ratón: el primero es un modelo clásico para el estudio de esta enfermedad, que muestra una translocación cromosómica que se da en la inmensa mayoría de los casos de linfoma folicular. El segundo fue creado con la novedosa técnica de edición genética CRISPR-Cas9, en el que además de la translocación, los investigadores indujeron la mutación en RagC.
“Lo que hemos visto es que, con la mutación que hemos inducido en RagC, este gen está siempre en modo on”, explica Efeyan, jefe del Grupo y autor principal del estudio. “Esto hace que las células B que han participado en una respuesta inmunitaria crean que tienen nutrientes para crecer y lo hagan descontroladamente. Nuestro estudio confirma que las mutaciones en RagC están en el origen de la enfermedad y, por lo tanto, nos encontramos ante la primera evidencia de actividad promotora de tumores de RagCy de todo el conjunto de genes que informa a mTOR de la presencia de nutrientes para crecer”.
Fuente: ConSalud.es













